Checkpoint Inhibitor
- Martin Döhring

- 3. Apr. 2023
- 3 Min. Lesezeit
Aktualisiert: 21. Sept. 2025
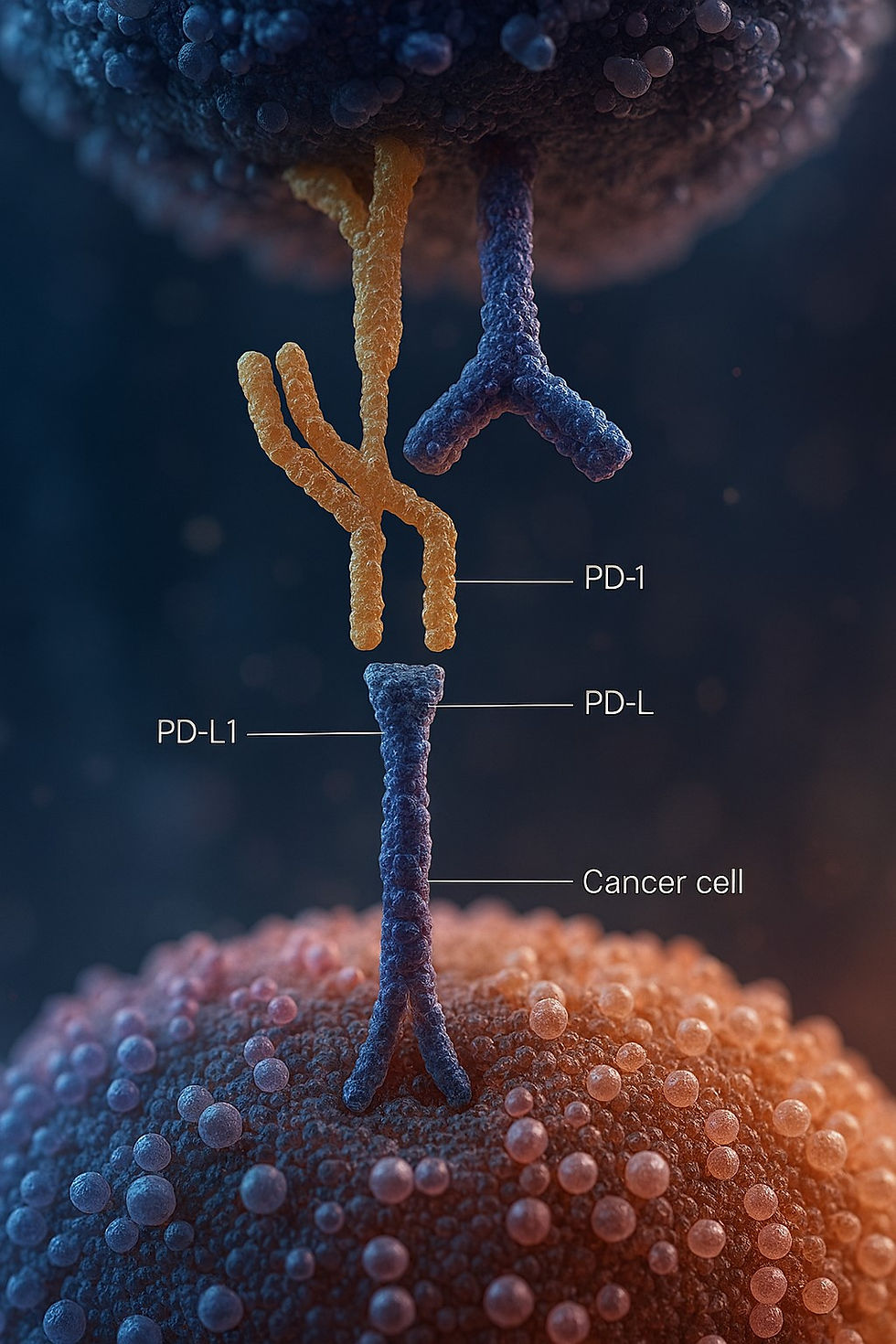
Checkpoint-Inhibitoren sind eine Klasse von Immuntherapeutika, die in der Krebstherapie eingesetzt werden, um die Immunantwort gegen Tumorzellen zu verstärken. Sie wirken, indem sie spezifische molekulare Signalwege blockieren, die normalerweise die Aktivität des Immunsystems hemmen. Um dies auf molekularer Ebene zu verstehen, erkläre ich die Mechanismen, die beteiligten Moleküle und deren Interaktionen Schritt für Schritt.
### 1. Grundlagen der Immun-Checkpoints
Immun-Checkpoints sind regulatorische Signalwege, die die Aktivität von T-Zellen (eine zentrale Komponente des Immunsystems) kontrollieren, um eine überschießende Immunantwort oder Autoimmunreaktionen zu verhindern. Sie bestehen aus Rezeptor-Ligand-Paaren, die auf T-Zellen und anderen Zellen (z. B. Tumorzellen oder antigenpräsentierenden Zellen) exprimiert werden. Zwei der am besten untersuchten Checkpoint-Systeme sind:
- PD-1/PD-L1-Achse:
- PD-1 (Programmed Death-1): Ein Rezeptor auf der Oberfläche aktivierter T-Zellen.
- PD-L1 (Programmed Death-Ligand 1): Ein Ligand, der auf Tumorzellen oder anderen Zellen exprimiert wird.
- Interaktion: Wenn PD-1 an PD-L1 bindet, wird ein inhibitorisches Signal in die T-Zelle gesendet, das die T-Zell-Aktivität (Proliferation, Zytokinproduktion, Zytotoxizität) dämpft.
- CTLA-4/CD80-CD86-Achse:
- CTLA-4 (Cytotoxic T-Lymphocyte Antigen 4): Ein Rezeptor auf T-Zellen, der in der frühen Phase der T-Zell-Aktivierung exprimiert wird.
- CD80/CD86: Liganden auf antigenpräsentierenden Zellen (APCs).
- Interaktion: CTLA-4 konkurriert mit dem co-stimulatorischen Rezeptor CD28 um die Bindung an CD80/CD86. CTLA-4 hat eine höhere Affinität und hemmt dadurch die T-Zell-Aktivierung.
Tumorzellen nutzen diese Checkpoints, um sich der Immunüberwachung zu entziehen, indem sie z. B. PD-L1 hochregulieren, um T-Zellen zu deaktivieren.
### 2. Molekularer Mechanismus von Checkpoint-Inhibitoren
Checkpoint-Inhibitoren sind in der Regel monoklonale Antikörper, die spezifisch an PD-1, PD-L1 oder CTLA-4 binden und deren Interaktion mit ihren Liganden blockieren. Dadurch wird die Immunhemmung aufgehoben, und die T-Zellen bleiben aktiv, um Tumorzellen anzugreifen. Die molekularen Details sind:
#### a) PD-1/PD-L1-Inhibitoren
- Beispiele: Pembrolizumab, Nivolumab (anti-PD-1); Atezolizumab, Durvalumab (anti-PD-L1).
- Molekulare Wirkung:
- PD-1 ist ein Transmembranprotein der Immunoglobulin-Superfamilie. Es enthält ein intrazelluläres ITIM (Immunoreceptor Tyrosine-based Inhibitory Motif), das bei Bindung an PD-L1 phosphoryliert wird.
- Die Phosphorylierung aktiviert Phosphatasen wie SHP-2, die Signalwege wie PI3K/AKT oder MAPK deaktivieren, was die T-Zell-Aktivität (Proliferation, Zytokinproduktion) hemmt.
- Monoklonale Antikörper gegen PD-1 oder PD-L1 verhindern diese Interaktion. Dadurch bleibt das ITIM inaktiv, und die T-Zelle wird nicht gehemmt, sondern bleibt zytotoxisch aktiv.
- Ergebnis: T-Zellen können Tumorzellen durch Freisetzung von Perforinen und Granzymen zerstören.
#### b) CTLA-4-Inhibitoren
- Beispiel: Ipilimumab.
- Molekulare Wirkung:
- CTLA-4 wird nach T-Zell-Aktivierung hochreguliert und bindet mit hoher Affinität an CD80/CD86 auf APCs, wodurch die co-stimulatorische Signalübertragung durch CD28 blockiert wird.
- Normalerweise aktiviert die CD28-CD80/CD86-Bindung Signalwege wie NF-κB und AP-1, die die T-Zell-Proliferation und Zytokinproduktion fördern.
- Anti-CTLA-4-Antikörper blockieren die CTLA-4-CD80/CD86-Interaktion, sodass CD28 ungehindert mit CD80/CD86 interagieren kann, was die T-Zell-Aktivierung verstärkt.
- Ergebnis: Verstärkte T-Zell-Aktivierung in Lymphknoten, was die Immunantwort gegen Tumorzellen fördert.
### 3. Molekulare Interaktionen und Signalwege
Die molekularen Interaktionen lassen sich wie folgt zusammenfassen:
- PD-1/PD-L1:
- Bindung: PD-1 (T-Zelle) bindet PD-L1 (Tumorzelle/APC) über extrazelluläre Domänen.
- Signalweg: ITIM-Phosphorylierung → SHP-2-Rekrutierung → Hemmung von PI3K/AKT, MAPK → reduzierte T-Zell-Aktivität.
- Inhibitorwirkung: Antikörper blockieren die Bindung, verhindern SHP-2-Aktivierung, erhalten PI3K/AKT-Signale.
- CTLA-4:
- Bindung: CTLA-4 (T-Zelle) bindet CD80/CD86 (APC) und verdrängt CD28.
- Signalweg: CTLA-4 hemmt NF-κB und andere aktivierende Signalwege, indem es PP2A (Phosphatase) rekrutiert.
- Inhibitorwirkung: Antikörper blockieren CTLA-4, fördern CD28-Signale, aktivieren NF-κB.
### 4. Klinische Relevanz auf molekularer Ebene
- Tumor-Mikroumgebung: Tumorzellen exprimieren oft PD-L1 als Reaktion auf IFN-γ (ausgeschüttet von T-Zellen), was ein adaptiver Resistenzmechanismus ist. Checkpoint-Inhibitoren durchbrechen diese Barriere.
- Kombinationstherapien: Anti-PD-1 und Anti-CTLA-4 werden oft kombiniert, da sie unterschiedliche Phasen der T-Zell-Aktivierung ansprechen (CTLA-4 in Lymphknoten, PD-1 in der Tumor-Mikroumgebung).
- Nebenwirkungen: Die Blockade von Checkpoints kann Autoimmunreaktionen auslösen, da die physiologische Immunregulation gestört wird (z. B. Colitis, Hepatitis).
### Fazit
Checkpoint-Inhibitoren wirken, indem sie die Bindung von PD-1/PD-L1 oder CTLA-4/CD80-CD86 blockieren, wodurch inhibitorische Signalwege (SHP-2, PP2A) deaktiviert und aktivierende Signalwege (PI3K/AKT, NF-κB) gefördert werden. Dies verstärkt die T-Zell-Antwort gegen Tumorzellen. Auf molekularer Ebene sind sie ein gezielter Eingriff in die Immunregulation, mit weitreichenden Auswirkungen auf die Tumor-Mikroumgebung.








Checkpoint-Inhibitoren entfalten ihre Wirkung bei verschiedenen Krebsarten, indem sie die „Bremsen“ des Immunsystems lösen und T-Zellen wieder aktiv gegen Tumorzellen vorgehen lassen. Ihre Effektivität hängt stark von der Tumorart, der Mikroumgebung und der Expression von Zielmolekülen wie PD-L1 ab.
🧬 Wirkmechanismus bei verschiedenen Krebsarten
Krebsart
Checkpoint-Inhibitoren
Wirkung & Besonderheiten
Malignes Melanom PD-1 (Nivolumab, Pembrolizumab), CTLA-4 (Ipilimumab) Sehr hohe Immunogenität → starke T-Zell-Antwort. Kombinationstherapie zeigt hohe Ansprechraten.
Nicht-kleinzelliges Bronchialkarzinom (NSCLC) PD-1, PD-L1-InhibitorenGute Wirksamkeit bei hoher PD-L1-Expression. Oft Teil der Erstlinientherapie. Kleinzelliges Bronchialkarzinom (SCLC) PD-L1-Inhibitoren (z. B. Atezolizumab) Moderate Wirkung, oft in Kombination mit Chemotherapie.
NierenzellkarzinomPD-1, PD-L1, CTLA-4-Inhibitoren Kombinationen mit Tyrosinkinase-Inhibitoren zeigen Synergieeffekte.
UrothelkarzinomPD-1, PD-L1-Inhibitoren Gute Wirkung bei fortgeschrittenen Stadien, besonders bei hoher PD-L1-Expression.
Hodgkin-Lymphom PD-1-Inhibitoren Sehr effektiv, da Tumorzellen oft genetisch bedingt…
In der EU bereits zugelassen sind die Checkpoint Inhibitoren Ipilimumab, Nivolumab, Pembrolizumab, Avelumab, Alezolizumab.
Deren Indikationen sind: Melanom, nicht-kleinzelliges Bronchialkarzinom, Merkelezellkarzinom, Urothelkarzinom, klassisches Hodgkin-Lymphom, Niernzellkarzinom, Plattenepithelkarzinom im Kopf-Hals-Bereich
Checkpoint Inhibitoren
können bei Patienten mit metastasierendem Melanom das Überleben verlängern oder die Ansprechraten auf Therapie von 19-61% erhöhen. (Dtsch Ärzteblatt Int 2019;116:119-26)
Diese Checkpointhemmer sind künstlich im Labor hergestellt , als monoklonale Antikörper,
mit gewünschter Zusatzeigenschaft, die in der Natur so nicht vorkommt.
Von verschiedenen pharmazeutischen Herstellern wurden diverse verschiedene Checkpoint-Inhibitoren entwickelt. Diese wirken als CTLA-4 Inhibitor, oder als PD-1 Inhibitor oder als PD-L1 Hemmer. Die Checkpoint Inhibitoren führen zur einer Tumor-demaskierung.
Wirkungsspektrum bislang: malignes Melanom, NSCLC (großzelliges BCA), SCLC (=“small cell lung cancer“) Nierenzellkarzinom, Urothelkarzinom, HNO-Plattenepithel-Karzinom, Mammakarzinom, kolorektales Karzinom, Hodgkin-Lmyphom, Leberzellkarzinom, Merkelzellkarzinom, Zervixkarzinom.