Krankheitsbild Multiple Sklerose (Enzephalopathia disseminata)
- Martin Döhring

- 23. Sept. 2025
- 4 Min. Lesezeit
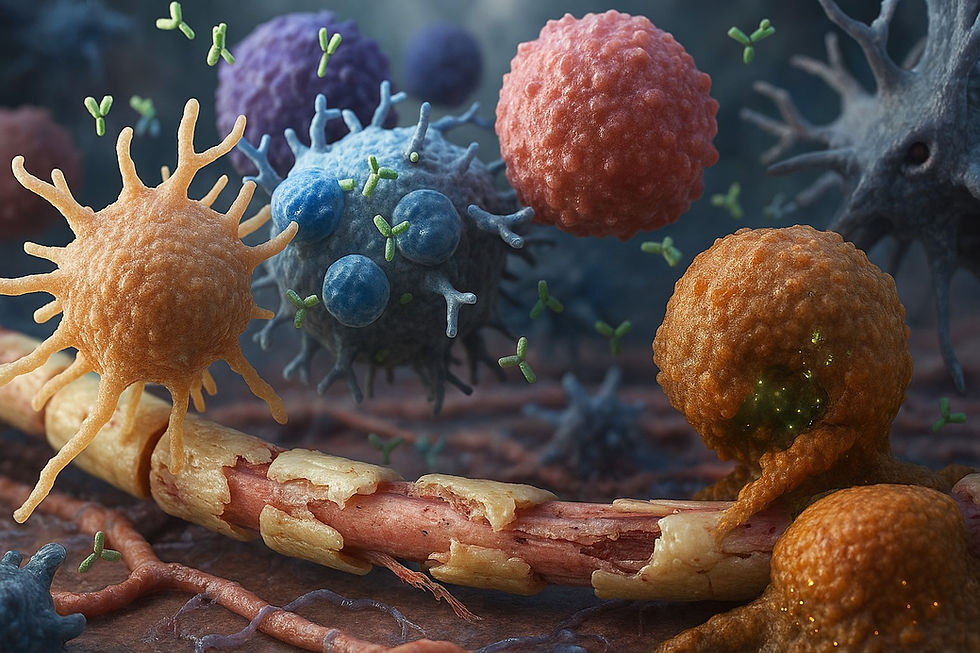
... hier eine ausführliche, molekularbiologische Erklärung zum Krankheitsbild Multiple Sklerose (MS). Ich strukturiere das in Kurzüberblick und dann tiefer nach Mechanismen (Auslöser, Immunantwort, Effektor-Mechanismen, axonale Schädigung, Remyelinisierung / Reparatur, Biomarker & therapeutische Implikationen).
Kurzüberblick
MS ist eine chronisch-entzündliche, immunvermittelte Erkrankung des zentralen Nervensystems (ZNS) mit fokaler Demyelinisierung, Verlust von Oligodendrozyten, intrathekaler (ZNS-lokaler) Antikörperproduktion und fortschreitender axonal-neuronal Schädigung. Klinisch sehen wir schubförmige Entitäten und progressive Verläufe — auf molekularer Ebene sind dafür überlappende immunologische und neurodegenerative Prozesse verantwortlich. (PubMed)
1) Prädisposition / Auslöser (Genetik × Umwelt)
Genetik: Das stärkste genetische Risiko liegt im MHC-II-Lokus, vor allem dem Allel HLA-DRB1*15:01, das die Peptidpräsentation an CD4⁺-T-Zellen verändert und damit Autoimmunität begünstigt.
Umweltfaktoren: Epidemiologische Daten zeigen starke Assoziationen zu Faktoren wie Vitamin-D-Mangel, Rauchen, Adipositas im Jugendalter und — besonders bedeutsam — Infektion mit Epstein-Barr-Virus (EBV). Eine große Kohortenstudie fand, dass EBV-Serokonversion dem Auftreten von MS deutlich vorangeht und das Risiko stark erhöht, was EBV als wichtigen Auslöser nahelegt (wobei Infektion allein nicht ausreichend ist — weitere Faktoren sind erforderlich). (Wissenschaft.org)
2) Wie die Immunantwort initiiert werden kann — Antigen-Erkennung & „Priming“
Antigen-Präsentation: In genetisch empfänglichen Personen präsentieren dendritische Zellen / B-Zellen myelin-ähnliche Peptide in MHC-II (z. B. MBP, PLP, MOG) an naive CD4⁺-T-Zellen → Differenzierung zu pro-inflammatorischen Th1/Th17-Zellen (IFN-γ, IL-17, GM-CSF). Diese T-Zellen sind zentral für Rekrutierung weiterer Effektorzellen ins ZNS. (PubMed)
B-Zell-Beteiligung & EBV: B-Zellen sind nicht nur Antikörperproduzenten, sondern dienen als potente Antigen-Präsentierende Zellen (APCs) und Zytokin-Quellen. Epidemiologie + neuere molekulare Studien zeigen, dass EBV-Infektion die B-Zell-Reaktion fehlleiten kann: z. B. wurden clonally expanded B-Zell-Repertoires in MS-Patienten beschrieben, deren Antikörper sowohl gegen das EBV-Protein EBNA1 als auch gegen ein ZNS-Protein (GlialCAM) binden — ein plausibler Mechanismus für molekulare Mimikry und Autoimmunität. Das verbindet die epidemiologischen EBV-Befunde mit einem konkreten molekularen Mechanismus. (PMC)
3) Zelluläre und humorale Effektormechanismen — wie entsteht Demyelinisierung?
CD4⁺/CD8⁺-T-Zellen: Aktivierte T-Zellen (Th1/Th17) setzen entzündungsfördernde Zytokine frei, aktivieren Mikroglia/Makrophagen und helfen B-Zellen. CD8⁺-zytotoxische T-Zellen können direkt Zellen des ZNS schädigen (perforin/granzym-vermittelt). (PubMed)
B-Zellen / Antikörper: Intrathekale B-Zell-Antworten zeigen sich als oligoklonale IgG-Banden im Liquor (als Zeichen lokaler Antikörperproduktion). In experimentellen Modellen und pathologisch wurden myelin-spezifische Antikörper gezeigt, die Komplement aktivieren und Oligodendrozyten bzw. Myelin via komplementvermittelte Zytotoxizität angreifen können. Das erklärt, warum humoral vermittelte Prozesse in vielen Läsionstypen sichtbar sind. (BioMed Central)
Mikroglia / Makrophagen: Aktivierung führt zu Phagozytose von Myelinfragmenten, Freisetzung von ROS, NO und proteolytischen Enzymen → direkte myelin- und axonschädigende Effekte.
4) Warum axonale Schädigung auftritt (Mechanismen hinter neurologischer Behinderung)
Demyelinisierung allein erklärt akute Leitungsausfälle; dauerhafte Behinderung entsteht durch axonale Degeneration — molekular betrachtet passiert Folgendes:
Umlagerung/Up-Regulation von spannungsabhängigen Natriumkanälen (Nav1.2/Nav1.6) entlang dem demyelinierten Axon erhöht Na⁺-Einstrom, um die Leitung zu kompensieren. Das steigert ATP-Verbrauch (Na⁺/K⁺-ATPase). Bei Energieknappheit (z. B. durch Entzündung-induzierte Mitochondrien-Dysfunktion) versagt die Ionennet-Homöostase.
Na⁺/Ca²⁺-Austausch (Reverse Mode) führt zu intrazellulärem Ca²⁺-Anstieg → Aktivierung von Ca²⁺-abhängigen Proteasen (z. B. Calpaine), Zytoskelett-Abbau und axonaler Verlust.
Mitochondriale Dysfunktion & oxidativer Stress: Entzündungsmediatoren, ROS und direkte Schädigung der Mitochondrien reduzieren ATP-Produktion und erhöhen ROS, wodurch axonale Energiereserven aufgebraucht werden und Degeneration forciert wird. Diese mitochondriale Komponente ist ein Kernstück der Progression. (PMC)
5) Chronische / kompartmentalisierte Entzündung: warum manche Läsionen „schmoren“
Bei fortgeschrittenen/progressiven Verläufen finden sich im ZNS persistente, lokal abgeschlossene Entzündungsherde:
Meningeale tertiäre Lymphfollikel (B-Zell-Aggregate): lokal produzierte Antikörper und Zytokine können subpiale kortikale Läsionen begünstigen.
Chronic active / „smouldering“ lesions mit einem Rand aus aktivierten, eisenbeladenen Mikroglia/Makrophagen — sichtbar als paramagnetische Randsignale (PRLs) in speziellen MRT-Sequenzen — sind mit fortschreitender Schädigung und schlechterer Prognose assoziiert. Diese Kompartmentalisierung macht die Läsionskontrolle schwieriger. (PMC)
6) Remyelinisierung und Reparatur(sversagen)
Oligodendrozyten-Vorläuferzellen (OPCs) sind im Erwachsenenhirn vorhanden und können remyelinisieren. In MS scheitert das oft wegen: entzündungsbedingt toxischer Umgebung (IFN, TNF, IL-1β), inhibitorischer extrazellulärer Matrix, alterungsbedingten epigenetischen Veränderungen und fehlender pro-differenzierender Signale (Notch, Wnt, etc.). Das führt zu unvollständiger oder fehlender Wiederherstellung der Myelinscheide. (PMC)
7) Diagnostische & prognostische molekulare Marker (Kurz)
Liquor-Oligoklonale Banden (OCBs) = Zeichen intrathekaler IgG-Synthese (häufig, diagnostisch unterstützend).
Neurofilament light chain (NfL) im Blut/CSF = Marker axonaler Schädigung; korreliert mit Krankheitsaktivität und Therapieansprechen.
Bildgebung: paramagnetische Randsignale/PRLs, Gadolinium-Enhanzement (aktive Entzündung), volumetrische Atrophie als Zeichen neurodegenerativer Prozesse. (PMC)
8) Therapeutische Implikationen — wie Medikamente auf molekularer Ebene greifen (Auswahl)
Anti-CD20-Therapien (z. B. Ocrelizumab, Ofatumumab, Rituximab): depletieren B-Zellen → reduzieren Antigen-Präsentation, cross-talk mit T-Zellen und intrathekale Antikörperproduktion; klinisch starke Reduktion von Schüben und MRT-Aktivität belegt (OPERA/ORATORIO Studien). Das unterstreicht die zentrale Rolle von B-Zellen in MS-Pathogenese. (New England Journal of Medicine)
Blockade der Leukozyten-Trafficking (Natalizumab): blockiert α4-Integrin (VLA-4) und verhindert Lymphozyten-Eintritt über BBB → weniger Läsionen (wirkt auf den Schritt, bevor Zellen ins ZNS gelangen).
S1P-Modulatoren (Fingolimod u. a.): halten Lymphozyten in Lymphknoten (weniger ZNS-Infiltrate).
Neuro-/Mitochondrienschutz & Remyelinationsstrategien: experimentell werden Wege untersucht, Mitochondrien zu stabilisieren, oxidativen Stress zu verringern, OPC-Differenzierung zu fördern oder schädliche B-Zell-Aktivitäten (z. B. EBV-gezielt) auszubremsen — letztere Richtung (EBV-Interventionen / Impfstoff) ist ein aktuell sehr aktives Forschungsfeld angesichts der starken EBV-Assoziation. (Wissenschaft.org)
Kernaussagen (sehr kurz)
MS = immunvermittelte Entzündung + sekundäre neurodegeneration; beide Ebenen erklären klinische Schübe und bleibende Behinderung. (PubMed)
Epidemiologie + molekulare Studien stützen EBV stark als wichtigen Auslöser; molekulare Mimikry (z. B. EBNA1 ↔ GlialCAM) ist eine plausible Bindeglied-Hypothese. (Wissenschaft.org)
B-Zellen sind zentral (nicht nur Antikörperquellen): anti-CD20-Therapien zeigen hohe Wirksamkeit. (New England Journal of Medicine)
Axonale Degeneration folgt biochemisch aus ionen-/energie-Dysbalance und mitochondrialer Schädigung — das ist der Kern der Progression. (PMC)






Die Multiple Sklerose (MS) auf molekularer Ebene zu verstehen, bedeutet, einen komplexen, fehlgeleiteten Dialog zwischen dem Immunsystem und dem zentralen Nervensystem (ZNS) zu entschlüsseln. Es ist ein Prozess, der in Schüben verläuft und bei dem molekulare Fehlentscheidungen zu den sichtbaren Symptomen führen.
Hier ist eine ausführliche Erklärung des Krankheitsbildes auf molekularer und zellulärer Ebene.
Die Grundprämisse: Eine Autoimmunreaktion
Vereinfacht gesagt, ist MS eine chronisch-entzündliche Autoimmunerkrankung. Das eigene Immunsystem, das normalerweise Krankheitserreger bekämpft, greift fälschlicherweise die Strukturen des eigenen Zentralnervensystems (Gehirn und Rückenmark) an.
Das primäre Angriffsziel ist die Myelinscheide. Das ist eine fetthaltige, isolierende Hülle, die die Fortsätze (Axone) der Nervenzellen (Neuronen) umgibt – ähnlich der Kunststoffummantelung eines Elektrokabels.
Die Folge der Zerstörung: Die elektrischen Signale (Nervenimpulse) werden verlangsamt, unterbrochen…