Apoptose - Antikörper treiben Krebszellen in den Zelltod
- Martin Döhring

- 12. Sept. 2025
- 2 Min. Lesezeit
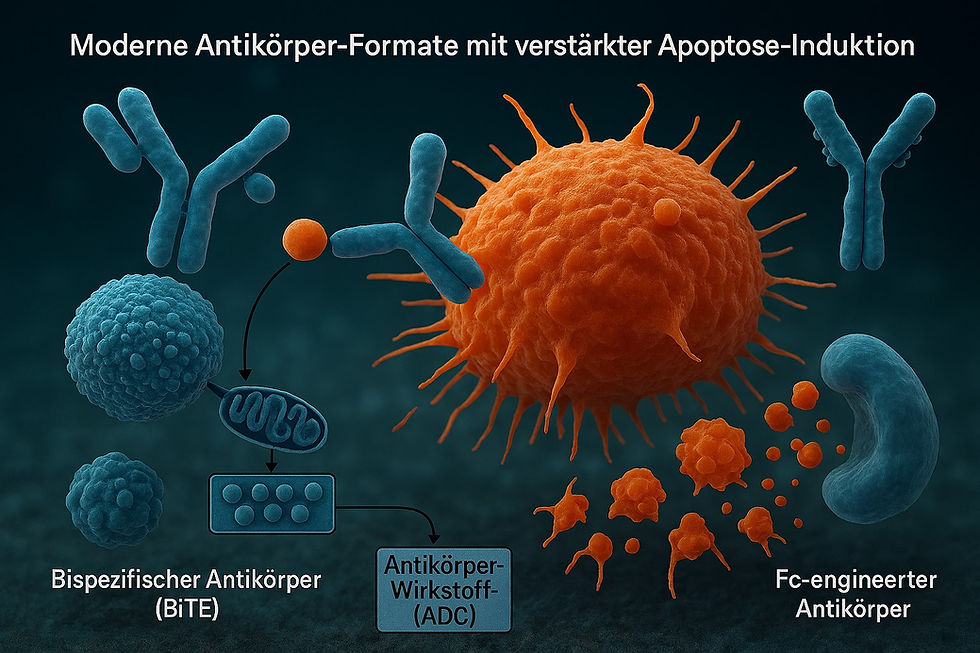
Schauen wir uns das Schritt für Schritt auf molekularer Ebene an: Es gibt mehrere Konzepte, wie Antikörper gezielt Apoptose in Krebszellen auslösen können.
1. Direkte Bindung an Todesrezeptoren (death receptor signaling)
Einige Antikörper sind gegen Todesrezeptoren der TNF-Rezeptor-Superfamilie gerichtet, z. B. TRAIL-R1 (DR4) oder TRAIL-R2 (DR5).
Diese Rezeptoren sitzen auf der Oberfläche von Tumorzellen.
Wenn ein Antikörper sie kreuzvernetzt, werden sie aktiviert → DISC (death-inducing signaling complex) bildet sich.
DISC rekrutiert FADD (Fas-associated death domain protein) und Pro-Caspase-8.
Caspase-8 wird aktiviert → aktiviert Caspase-3 → Zelle geht in Apoptose.
2. Indirekte Auslösung über Wachstumsrezeptoren
Viele therapeutische Antikörper (z. B. Trastuzumab gegen HER2, Cetuximab gegen EGFR) blockieren Wachstumsfaktor-Rezeptoren.
Normalerweise liefern diese Rezeptoren Survival-Signale (PI3K/AKT, MAPK).
Antikörper hemmen diese Signale → das Gleichgewicht kippt Richtung Pro-Apoptose.
Gleichzeitig können Tumorzellen dadurch empfindlicher gegenüber Chemotherapie oder Immuneffektorzellen werden.
3. Antikörper-abhängige zelluläre Zytotoxizität (ADCC)
Therapeutische Antikörper binden an ein Tumorantigen (z. B. CD20 bei Lymphomen → Rituximab).
Ihr Fc-Teil wird von Fcγ-Rezeptoren auf NK-Zellen, Makrophagen oder Granulozyten erkannt.
NK-Zellen setzen Perforin und Granzym B frei.
Perforin bildet Poren.
Granzyme aktivieren Caspase-3 direkt oder über die mitochondriale Achse (Bid → Bax/Bak → Cytochrom c).
Das resultiert in Apoptose der Tumorzelle.
4. Komplementaktivierung (CDC)
Manche Antikörper aktivieren Komplement (klassischer Weg → C1q bindet Fc).
Endprodukt ist MAC (membrane attack complex) → kann Zellen direkt zerstören.
Zusätzlich fördert Komplement die Phagozytose und verstärkt apoptotische Signalwege.
5. Mitochondrialer Weg (intrinsische Apoptose)
Indirekt: Durch Blockade von Survival-Signalen oder durch crosslinking bestimmter Oberflächenantigene (z. B. CD20 durch Rituximab).
Es kommt zur Aktivierung von Bax/Bak → Mitochondrien setzen Cytochrom c frei.
Cytochrom c + Apaf-1 + dATP → Apoptosom → Caspase-9 → Caspase-3 → Apoptose.
🔑 Kurz gesagt: Antikörper können Tumorzellen über mehrere Ebenen in die Apoptose treiben:
direkt durch Aktivierung von Todesrezeptoren,
indirekt durch Blockade von Überlebenssignalen,
durch Immunzellen (ADCC) oder Komplement,
und über mitochondriale Kaskaden.









1. Direkte Bindung an Todesrezeptoren (Death Receptor Signaling)
Deine Beschreibung ist präzise: Antikörper gegen TRAIL-Rezeptoren (z. B. DR4/DR5) oder Fas (CD95) können durch Crosslinking die extrinsische Apoptose-Kaskade initiieren. Der DISC-Komplex mit FADD und Pro-Caspase-8 führt tatsächlich zu Caspase-8-Aktivierung, die dann Effektorkaspasen wie Caspase-3 aktiviert. Ergänzung: In klinischen Ansätzen werden agonistische Antikörper entwickelt, die speziell diese Rezeptoren auf Tumorzellen aktivieren, ohne gesunde Zellen zu stark zu beeinträchtigen – ein Beispiel ist Mapatumumab (gegen DR4).
2. Indirekte Auslösung über Wachstumsrezeptoren
Richtig, Antikörper wie Trastuzumab (Herceptin) oder Cetuximab blockieren Rezeptortyrosinkinasen (z. B. HER2 oder EGFR), was zu einer Unterdrückung pro-survival Pathways wie PI3K/AKT und MAPK führt. Das verschiebt das Gleichgewicht hin zu pro-apoptotischen Signalen, oft verstärkt durch Kombinationstherapien. Zusätzlich können diese Antikörper Zellzyklusarrest…